Esta web utiliza cookies para que podamos ofrecerte la mejor experiencia de usuario posible. La información de las cookies se almacena en tu navegador y realiza funciones tales como reconocerte cuando vuelves a nuestra web o ayudar a nuestro equipo a comprender qué secciones de la web encuentras más interesantes y útiles.
 María Martínez Molledo, primera autora del artículo, y Óscar Llorca, co-autor principal, investigadora y jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el DNA del CNIO. Crédito: Esther Sánchez / CNIO.
María Martínez Molledo, primera autora del artículo, y Óscar Llorca, co-autor principal, investigadora y jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el DNA del CNIO. Crédito: Esther Sánchez / CNIO.
La proteína Asc-1 es la vía de entrada a las neuronas (o la de salida) para aminoácidos fundamentales en procesos cognitivos. Un nuevo trabajo desvela ahora su estructura y mecanismo de actuación.
Es una colaboración del CNIO, el IRB Barcelona, la Universidad de Barcelona y el CIBERER, que se publica en Nature Communications.
El hallazgo podría servir para diseñar fármacos contra la esquizofrenia, el ictus y otras enfermedades neurológicas.
Aprender de una experiencia, recordar una anécdota, modificar una actitud… todo nuestro comportamiento es el resultado del intercambio de compuestos químicos entre neuronas –los neurotransmisores. Desentrañar qué ocurre exactamente a escala molecular cuando las neuronas hablan entre sí, en las sinapsis, es indispensable para entender el cerebro humano en general, y en particular para contribuir a solucionar problemas de salud mental.
Un nuevo estudio ha conseguido observar y describir la estructura de una proteína presente en la membrana de las neuronas, una proteína que actúa como una compuerta que se abre y se cierra. Actúa como transportador específico para determinados aminoácidos claves para el aprendizaje y la memoria. Se trata de la proteína Asc1/CD98hc, Asc1 en su forma abreviada.
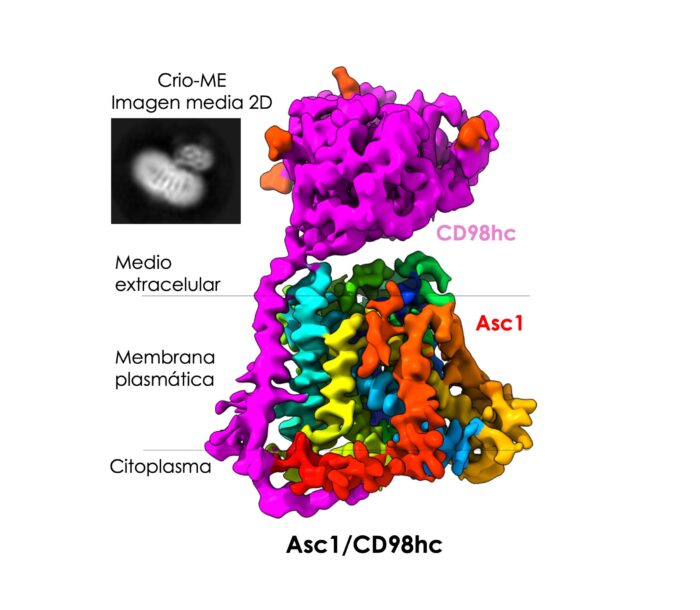
Inserción: imagen de microscopía electrónica, en la que se aprecia el componente CD98hc, sobresaliendo de la membrana, y bandas transversales correspondientes a la proteína Asc1
La actividad de la proteína Asc-1 se ha relacionado con distintos tipos de enfermedad mental, y conocer su forma tridimensional permitirá el desarrollo de nuevos fármacos para estas patologías.
Lo explica Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el DNA del CNIO: “Modular la actividad de Asc-1 puede ser una estrategia terapéutica en afecciones como el ictus y la esquizofrenia. La determinación de la estructura de Asc-1 a resolución atómica es importante porque puede ayudar en la búsqueda de compuestos que modifiquen su actividad”.
“La colaboración entre el IRB Barcelona, el CNIO y la UB ha sido clave para desentrañar los misterios de Asc-1, ofreciéndonos una visión sin precedentes de su estructura y funcionamiento. Este descubrimiento no solo arroja luz sobre la compleja maquinaria celular subyacente a procesos cognitivos fundamentales, sino que también nos acerca al desarrollo de intervenciones terapéuticas más precisas para una gama de trastornos neurológicos”, añade Manuel Palacín, jefe del laboratorio de Transportadores de Aminoácidos y Enfermedad del IRB Barcelona y catedrático del Departamento de Bioquímica y Biomedicina Molecular de la Facultad de Biología de la UB.
Además de Óscar Llorca y Manuel Palacín, es co-autor de este trabajo Ekaitz Errasti-Murugarren, de la Universidad de Barcelona y el CIBERER. Los primeros firmantes son Josep Rullo-Tubau (IRB Barcelona) y María Martínez Molledo (CNIO). Martinez Molledo llegó al CNIO con un contrato postdoctoral financiado por la iniciativa filantrópica “Amigos del CNIO“.
La financiación procede en su mayor parte de la Fundación “la Caixa” y el Ministerio de Ciencia, Innovación y Universidades.

Implicación en enfermedades neurológicas
Todas las células del organismo tienen en su membrana compuertas para intercambiar sustancias con el medio exterior: proteínas que están continuamente abriéndose y cerrándose según las necesidades de la célula. Se abren hacia el interior, cogen por ejemplo un aminoácido y, con una modificación en su forma, lo liberan abriéndose hacia el exterior, o viceversa.
La proteína Asc-1 está principalmente en las neuronas del hipocampo y la corteza cerebral, en el cerebro. Se especializa en introducir y/o sacar de la neurona dos aminoácidos fundamentales para las conexiones neuronales (las sinapsis) implicadas en el aprendizaje, la memoria y la plasticidad cerebral –la capacidad del sistema nervioso de modificar sus circuitos en respuesta a nuevos entornos–.
Las fluctuaciones en el suministro de estos aminoácidos, llamados D-serina y glicina, se han asociado a la esquizofrenia, los infartos cerebrales, la ELA y otras enfermedades neurológicas. Hace tiempo que se intenta diseñar fármacos que regulen la actividad de Asc-1 para tratar estas enfermedades, pero sin éxito. Conocer con detalle la estructura atómica de Asc-1 aporta información clave para lograrlo.
Cazada cuando se abría al interior
La proteína Asc-1 fue purificada por Josep Rullo-Tubau en el IRB Barcelona, y transferida al CNIO para que María Martínez-Molledo las observara con crío-microscopía electrónica y con estas imágenes pudiera determinar la estructura de Asc-1 en 3D y alta resolución. En la crío-microscopía electrónica las moléculas se congelan a alta velocidad y se observan en microscopios electrónicos; después se emplean avanzadas técnicas de imagen para interpretar la información.
La estructura observada muestra Asc-1 cuando ha sido atrapada en un estadio en que la compuerta estaba abierta hacia el interior de la célula, esperando a recibir un aminoácido para ser transportado.
“A partir de su estructura atómica pudimos predecir qué partes de la proteína parecen ser importantes para unir el aminoácido que va a ser transportado, y el posible mecanismo para su transporte hacia el exterior de la célula”, afirma Llorca.
Los grupos de Víctor Guallar (Centro de Supercomputación de Barcelona) y Lucía Díaz (Nostrum Biodiscovery) realizaron estas predicciones sobre el funcionamiento del transportador que fueron testadas por Rullo-Tubau, mediante la medición del efecto de mutaciones específicas en Asc-1, que fueron complementados por Rafael Artuch (Hospital San Joan de Deu) y la plataforma científica de Bioestadística y Bioinformática del IRB Barcelona, que lidera Camille Stephan-Otto Attolini.
Dos modus operandi
Las conclusiones contribuyen además a explicar otra particularidad de Asc-1. A El resto de la familia de transportadores a la que pertenece, llamada HAT, solo pueden transportar un aminoácido hacia dentro de la célula cuando sacan otro, y viceversa. Es decir, funcionan únicamente intercambiando aminoácidos. Asc-1, sin embargo, puede también extraer un aminoácido sin necesidad de introducir otro y abrirse y cerrarse “en vacío”. Este modo de actividad se llama difusión.
Los resultados obtenidos sobre la estructura molecular de Asc-1 aportan datos para comprender mejor la función que ejerce cada uno de los modos de transporte.
Artículo de referencia
Referencia del artículo:
Rullo-Tubau, J., Martinez-Molledo, M., Bartoccioni, P. et al. “Structure and mechanisms of transport of human Asc1/CD98hc amino acid transporter”. Nat Commun 15, 2986 (2024).
